Il glaucoma nella sindrome pseudoesfoliativa
Il glaucoma che deriva dalla sindrome pseudoesfoliativa è un glaucoma ad angolo aperto che si sviluppa in occhi affetti da sindrome da pseudoesfoliatio capsulae ed è caratterizzato dalla specifica tendenza a progredire in senso peggiorativo in tempi particolarmente rapidi; si tratta di una forma di glaucoma “cronico” che necessita del trattamento più tempestivo ed aggressivo rispetto al normale glaucoma ad angolo aperto.
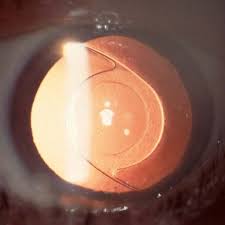
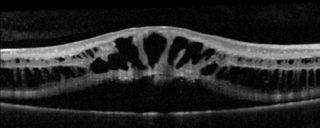
La sindrome da cui ha origine è una situazione clinica caratterizzata dalla produzione di un materiale furfuraceo da parte probabilmente della superficie del cristallino, che si deposita su tutte le superfici intraoculari; a lungo andare questo materiale intasa il trabecolato; il che determina un aumento cospicuo della pressione intra oculare cui consegue il glaucoma vero e proprio.
Il materiale esfoliativo si deposita a livello dell’angolo irido-corneale, intasando il trabecolato, riducendo l’eliminazione dell’umore acqueo, e di conseguenza, aumentando la pressione intra oculare.
Gli occhi affetti da questo tipo di glaucoma, per definizione glaucoma ad angolo aperto, sviluppano in circa il 20% dei casi un glaucoma ad angolo stretto/chiuso; è quindi buona norma assicurarsi sempre del grado di apertura dell’angolo irido-corneale, perché è necessario che il trattamento tenga conto di questo aspetto.
Caratteristiche di questo tipo di glaucoma sono:
- pressione intra oculare piuttosto elevata (anche > 40 mmHg);
- marcata fluttuazione giornaliera della pressione oculare;
- glaucoma aggressivo che evolve più rapidamente;
- difficoltà a dilatare farmacologicamente la pupilla;
- indebolimento dell’apparato sospensorio del cristallino;
- maggiore rischio di cataratta nucleare;
- patologia bilaterale anche se spesso la PEX è visibile in un solo occhio.
TRATTAMENTO
il trattamento è lo stesso del glaucoma ad angolo aperto, ma deve essere più tempestivo ed aggressivo; il trattamento laser (trabeculoplastica) è una buona opzione, perché nei pazienti affetti da questa patologia l’efficacia è spesso buona, anche se non duratura. Il trattamento chirurgico (trabeculectomia), va eseguito quanto prima, non appena il trattamento medico o quello con laser dimostrino di essere inefficaci
La facoemulsificazione, tecnica chirurgica utilizzata per l’estrazione della cataratta; va comunque eseguita in tempi più rapidi possibili in un simile quadro clinico; sempre quando è presente la cataratta, anche se iniziale, spesso anche quando il cristallino si presenta ancora trasparente perché nei casi con PEX tale intervento può indurre un significativo abbassamento della pressione e perché l’intervento è decisamente più sicuro per l’occhio
Infatti operare quando la pupilla non si dilata più a sufficienza in seguito alla sindrome si aumenta il rischio intra-operatorio, inoltre gli occhi con PEX hanno spesso la necessità, come sopra illustrato, di un intervento per glaucoma, la cui esecuzione risulta decisamente più sicura se il cristallino è già stato eliminato (facoemulsificato). Per contro, In un piccolo numero di casi, si può sviluppare un ipertono intrattabile se non chirurgicamente; ciò si può verificare in casi con PEX presente da molto tempo oppure in occhi con cataratta avanzata; in questo caso l’intervento va approntato con attenzione ed eseguito da chirurghi esperti.
Il paziente in cura affetto da questa patologia va comunque sotto posto a controlli periodici accurati e ravvicinati; 3/6 mesi a discrezione dello specialista, facendo attenzione che i controlli siano eseguiti anche quando l’occhio sia stato operato apparentemente con successo, perché la produzione di materiale esfoliativo continua per tutta la vita, e bisogna quindi essere sicuri che il quadro clinico nel tempo non si scompensi di nuovo.

Alcuni integratori alimentari a base di vitamina A e omega3 possono facilitare la riduzione della produzione e l’eliminazione del materiale esfoliativo tipico della patologia.

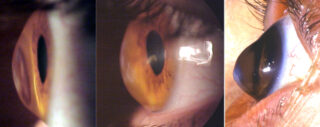


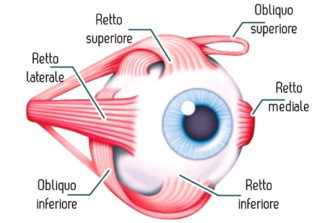
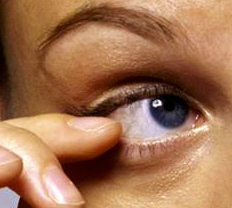 Questi microrganismi sono stati isolati da fonti ambientali sia naturali che artificiali, tra cui acqua dolce e salata, suolo, aria, fontane cittadine e piscine. Possono causare un’infezione corneale progressiva e pericolosa per la vista nota come cheratite da Acanthamoeba.
Questi microrganismi sono stati isolati da fonti ambientali sia naturali che artificiali, tra cui acqua dolce e salata, suolo, aria, fontane cittadine e piscine. Possono causare un’infezione corneale progressiva e pericolosa per la vista nota come cheratite da Acanthamoeba.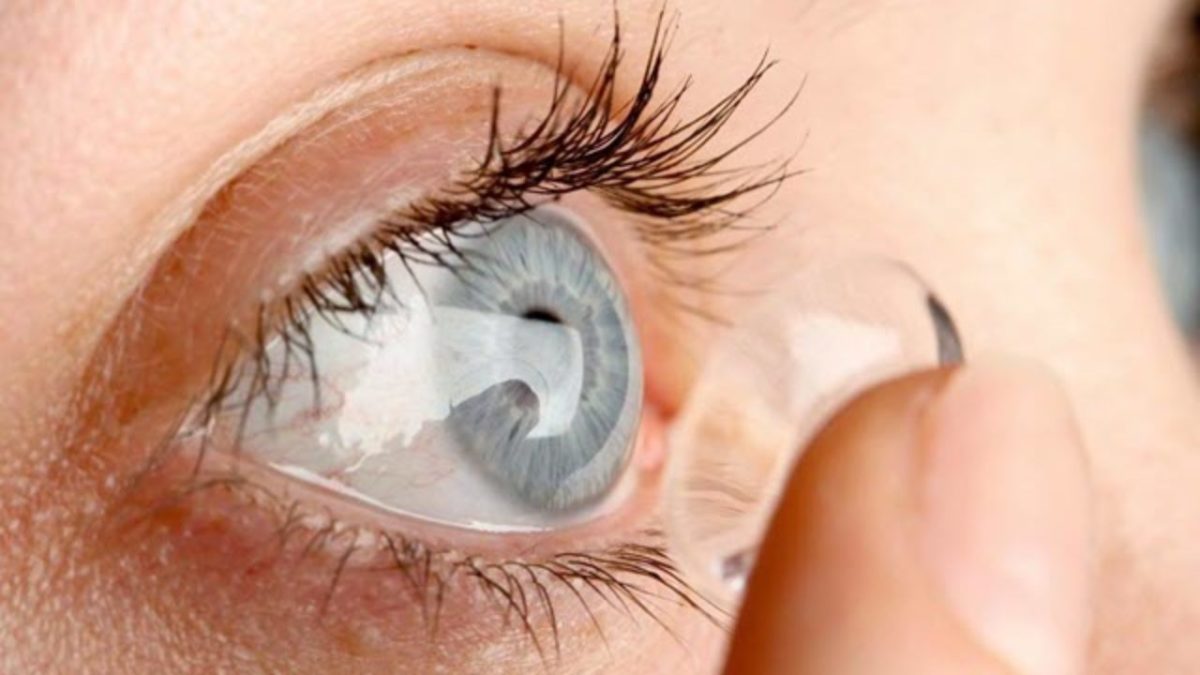
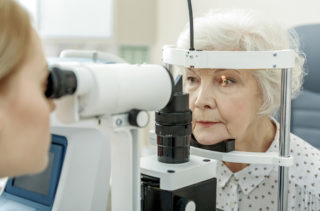
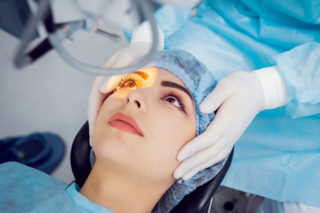
 Al fine di ridurre al minimo gli effetti collaterali e le eventuali complicanze e ottimizzare la sicurezza del trattamento l’ultima frontiera della tecnologia in questo campo. Si tratta di un innovativo laser YAG a nanosecondi che emette una radiazione luminosa della durata di una frazione di miliardesimi di secondo.
Al fine di ridurre al minimo gli effetti collaterali e le eventuali complicanze e ottimizzare la sicurezza del trattamento l’ultima frontiera della tecnologia in questo campo. Si tratta di un innovativo laser YAG a nanosecondi che emette una radiazione luminosa della durata di una frazione di miliardesimi di secondo.